Southern blot
El southern blot, o hibridación Southern es una técnica empleada en los laboratorios de biología molecular que se usa para detectar secuencias de ADN específicas a partir de un preparado de tejido. También se utiliza esta técnica como “prueba del ADN” para detectar la presencia del ADN de un individuo en un lugar.
El nombre de esta técnica se debe al inventor de la misma, el biólogo británico Edwin Southern. El trabajo de esta técnica apareció en el Journal of Molecular Biology, número 98, en 1975. Desde entonces se han implementado algunas mejoras, aunque el procedimiento básico es el mismo. A raíz de la creación de la técnica del southern, se han desarrollado técnicas para detectar y separar secuencias de ARN, denominadas Northern blot y para proteínas, llamadas Western blot de las que puedes leer más aquí y aquí . Además otras técnicas híbridas se han creado como el northwestern, para agregados de ARN y proteínas o el Eastern blot para ARN modificado postranscripcinalmente.
Antes de poder realizar el Southern blot propiamente dicho hay que extraer y purificar el ADN. Ésta puede ser tanto de tejido animal, vegetal, etc. Las técnicas de extracción son muy diversas. Existen protocolos de extracción especializados para muchos tipos de tejidos diferentes o tipos celulares. Una vez obtenido un ADN purificado se corta con enzimas de restricción para obtener fragmentos de diferentes tamaños. Puedes leer más sobre los enzimas de restricción en el artículo que le dedicamos aquí. Si hay poco ADN muchas veces se aumenta el número de copias mediante una PCR (reacción en cadena de la polimerasa) de la que puedes leer más aquí.
Una vez tenemos el ADN digerido con enzimas y en cantidad suficiente se corre una electroforesis en un gel de agarosa para separar los diferentes fragmentos de ADN según su tamaño. Puedes leer más sobre la electroforesis en geles de agarosa en nuestro artículo aquí. Ahora ya tenemos el ADN separado por tamaño de la doble hebra. En este punto se baña el gel en un tratamiento alcalino, normalmente hidróxido de sodio (NaOH). Con esto se consigue separar la doble hebra y eliminar los restos de ARN que puedan quedar.
A partir de este punto empieza el southern blot propiamente dicho. En este momento se traspasa el ADN del gel a una membrana de nailon. El paso de las bandas del gel a la membrana se realiza gracias a la movilidad del ADN desde el gel a la membrana por polaridad del ADN, que puede facilitarse poniendo el «sandwich» en un campo electrico. Este paso, que puede durar varias horas dependiendo del tamaño del ADN que queramos traspasar, es el blot o “copia”, quedando en la membrana las mismas bandas que aparecían en el gel de agarosa. La membrana «seca» el gel, sacandole el ADN.
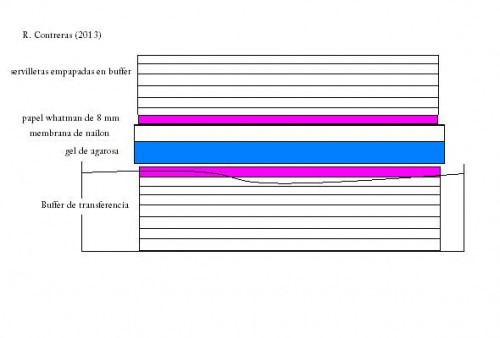
El «sandwich» de una transfetencia.
La membrana de nailon, que ahora contendrá el ADN, se incuba en una solución salina que contiene una sonda de ADN o ARN complementaria a una secuencia específica que queremos encontrar en la membrana. La sonda se construye con nucleótidos, añadiendo el fosfato radioactivo o uniendo la sonda a una molécula fluorescente para poder verla más adelante.
Finalmente se revela con una película fotográfica, si la sonda es radioactiva o con luz fluorescente si es el caso. Esta prueba permite diferenciar dos individuos que tengan diferencias en la diana de un enzima de restricción, es decir que uno la tenga y otro no.
