Agentes infecciosos poco usuales: viroides y priones
Si a los primeros microbiólogos les pareció extraño el descubrimiento de los virus por su pequeño tamaño y el hecho de que no puedan ser considerados seres vivos al carecer de células, la investigación les ofrecía una sorpresa aún mayor: existen agentes infecciosos mucho más extraños y pequeños que los virus: los viroides y los priones.
Ninguno de ellos está formado por células, y los priones parecen contradecir los «dogmas» básicos en la biología molecular, pues parecían reproducirse como agentes infecciosos aunque en realidad eran proteínas, sin que los ácidos nucleicos -de ordinario los portadores de la herencia- apareciesen en su composición. Tienen una forma definida, pero parecen estar compuestos únicamente por una proteína. No obstante, la partícula del prión parece ser infectiva sin tener ácido nucleico. Esto estaría en contradicción con el actual paradigma de que toda la información genética se acumula en moléculas de ácido nucleico. ¿Cómo producen la infección los priones?
 Los viroides.
Los viroides.
Alrededor de una docena de infecciones en vegetales son atribuidas a unas moléculas de ARN circular de una sola cadena, de unos 300 nucleótidos que, curiosamente, no codifican a ninguna proteína, pero su multiplicación en el interior de las células a las que infectan causa enfermedades a la planta huésped. Los más característicos son el viroide del exocortis de los cítricos y el del cadang-cadag del coco.
Fueron descubiertos en 1971 y son unas diez veces más pequeños que los virus ordinarios. Se agrupan en dos familias taxonómicas: Pospiviroidae y Avsunviroidae.
Enfermedades por priones
Los priones son proteínas que de forma ordinaria son fabricados en las células nerviosas, para sus propias funciones. Por razones no bien conocidas en ocasiones estas proteínas se pliegan mal, con lo que tienen efectos patógenos en el sistema nervioso de los animales infectados. Curiosamente estas proteínas «mal plegadas» pueden a su ver inducir la aparición de más priones modificados, con la que la patología adquiere carácter de infección, cuando estos priones llegan hasta animales o seres humanos sanos, en principio por via digestiva.
Las encefalopatías espongiformes (como la bovina o mal de las «vacas locas», el «scrapie» y el Creutzfeldt-Jakob) se inician por una alteración de las proteínas. Se han relacionado estas partículas con enfermedades degenerativas del sistema nervioso con un componente infectivo, como la enfermedad de Creutzfeldt-Jakob o el Kuru, en el hombre, y la enfermedad de las «vacas locas», que se transmite al ser humano, produciendo un tipo especial de encefalopatía espongiforme.
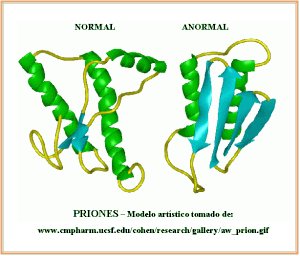
El prión puede adoptar dos formas: la benigna o normal y la infecciosa (el prión propiamente dicho). Cuando la proteína normal se convierte en infecciosa cambia su estructura.
Se ha descubierto que la célula hospedadora contiene la información para codificar a la proteína del prión. La presencia de la proteína infectiva provoca la aparición de mayor cantidad de proteína codificada por el huésped. Además, esta proteína modifica su estructura tridimensional de manera poco conocida, de modo que la presencia de proteína del prión transforma la proteína normal en proteína del prión infectiva.
La proteína del prión (PrP) es, habitualmente, inofensiva. En su forma benigna, la estructura se dobla en múltiples hélices.