La familia de las chaperonas
Las chaperonas son las encargadas del plegamiento correcto, de la estabilidad de la conformación tridimensional (estructura terciaria) y del transporte hasta su destino de otras proteínas. Están presentes en todos los organismos, tanto procariotas como eucariotas. Estas importantes proteínas se encargan del plegamiento de proteínas a medida que se van traduciendo en los ribosomas del Retículo endoplasmático y pasan al Aparato de Golgi (para saber más del retículo endoplasmático puedes leer el artículo que le dedicamos aquí y este otro para ver algunas cosas sobre el Golgi y otros orgánulos). Además también intervienen en el mantenimiento del plegamiento correcto de las proteínas en otras circunstancias, por ejemplo ante choques térmicos; variaciones, bruscas o no, de temperaturas, esto es especialmente importante en plantas puesto que no pueden moverse para alejarse del frio.
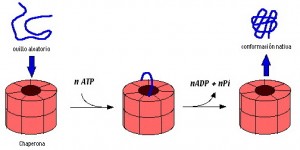
Muchas veces se necesita ATP (energía) para que las chaperonas consigan hacer adpotar la forma correcta a una proteína.
Decimos que una proteína se traduce cuando se crea una cadena de aminoácidos en el ribosoma a partir de un ARN mensajero que actúa como molde. Esta cadena aminoacídica va creciendo y presenta cargas positivas y negativas y colas hidrofílicas o hidrofóbicas que harán que la cadena adopte una conformación mediante la interacción con las cargas que tenga el medio (el citoplasma). Esta conformación no siempre es la correcta, sobretodo en proteínas de gran tamaño, puesto que las interacciones del conjunto de los 100 primeros aminoácidos no tienen porqué ser las mismas que las de toda la proteína ya formada. Para evitar que las proteínas adopten una conformación errónea las chaperonas se van uniendo a las proteínas nacientes y colaborando entre ellas ayudan a la proteína a conseguirla forma deseada o para conseguir la formación de agregados proteicos, que no siempre es lo más sencillo energéticamente o para evitar la formación de agregados proteicos con otras proteínas.
A las familias de respuesta a estrés térmico se las conoce como Hsp (Heat Shock Protein), están muy bien representadas en todos los organismos, desde bacterias y levaduras a animales y plantas. Se distribuyen en seis familias proteicas dependiendo de su peso molecular y son smallHsp, Hsp40, Hsp60, Hsp70, Hsp90 y Hsp110 cuyos pesos moleculares son menos de 40, 40, 60, 70, 90 y 110 kD (kiloDalton). Estas proteínas son realmente muy numerosas y comprenden genes de secuencias muy diferentes, aunque mantengan cierto grado de homología. Evidentemente su expresión aumenta como respuesta a situaciones de estrés térmico (se descubrieron en ese tipo de estudios), pero además al estrés hídrico, radiación, cambios de presión osmótica o a la falta de nutrientes y en general cualquier situación que cambie el pH celular y por consiguiente interfiera en la conformación de las proteinas. Tan solo un aumento de 5ºC activa la síntesis de estas proteínas.
Las chaperoninas comparten cierta homología en la secuencia de aminoácidos y tiene un peso molecular alrededor de 60 kD y son las encargadas del plegamiento en mitocondrias, cloroplastos y bacterias. Hsp60 es la encargada del plegamiento de proteínas en el citoplasma y de su transporte hasta la matriz mitocondrial o del cloroplasto. La proteína GroEL (en Escherichia coli) es su homólogo en bacterias, y con el que se hicieron los primeros experimentos de plegamiento de proteínas in vitro.
