¿Qué es una proteína G?
Las proteínas G son una familia proteica cuya función principal es llevar una señal desde un receptor en la membrana celular hasta una o varias proteínas diana. Las proteínas G son muy importantes en la transducción de señales. Son la tercera familia más grande de proteínas en las células eucariotas y se han descrito centenares de ellas. Las proteínas G intervienen en la transducción de señales muy diversas, es por eso que hay tantos tipos diferentes de éstas proteínas. Pueden intervenir en la señalización de la activación o silenciamiento de la traducción del ADN. Además están implicadas en la recepción de señales hormonales, neuronales, etc.
Las proteínas G reciben su nombre porque están asociadas a GTP (Guanosina TriFosfato, un homólogo del ATP, que en lugar de estar constituido por una adenina utiliza una guanosina). Éstas proteínas son capaces de hidrolizar la molécula de GTP a GDP (Guanosina DiFosfato), por lo que se dice que tienen actividad GTPasa.
Existen dos tipos de proteínas G clasificadas dependiendo de su estructura molecular en heterotriméricas y monoméricas.
Las proteínas G heterotriméricas son de gran tamaño y están constituidas por 3 subunidades (alfa, beta y gamma). Las subunidades alfa y gamma intervienen en la integración de la proteína G en la membrana citoplasmática.. La subunidad alfa, además, está unida a GDP, cuando la proteína G se encuentra en reposo. La proteína G se activa cuando se une a un receptor que ha recibido un estímulo, la unión se realiza a través del dímero beta-gamma. La subunidad alfa cuando la proteína G se une a un receptor modifica su conformación, liberando el GDP y aumentando su afinidad por GTP. Para facilitar el intercambio de GDP a GTP unas proteínas accesorias, denominadas GEF (Factor de intercambio de Guanina) se unen a la subunidad alfa.
Cuando se disocian, alfa-GTP y beta-gamma son capaces de interaccionar con otros receptores de membrana o citoplasmáticos, amplificando la señal. Entre sus dianas la alfa-GTP puede unirse a adenilato ciclasas, que formarán AMP cíclico, que a su vez aumentará la señal dentro de la célula.
Cuando la señal extracelular es liberada por el receptor de membrana las subunidades beta y gamma aumentan su afinidad por la subunidad alfa, que a su vez fosforila el GTP a GDP y se une a las otras dos subunidades, dejando el sistema en reposo de nuevo. Para facilitar la desfosforilación del GTP a GDP la proteína GAP (proteína aceleradora de la GTPasa) se une a la subunidad alfa.
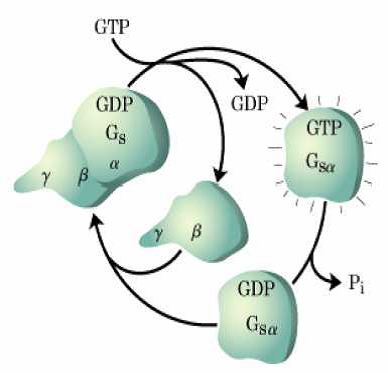
Esquema de proteína G de la octava edición del Journal of Feelsynapsis,
Las proteínas G monoméricas son de un tamaño mucho menor. En una sola subunidad tienen la actividad catalítica GTPasa y el dominio de reconocimiento de sus interactores. Estas GTPasas son más frecuentes en el citoplasma y solo se unen a la membrana cuando están activas.
Los receptores de señales que activan a las proteínas G suelen tener una estructura muy característica con 7 dominios transmembrana. Los receptores siempre presentan el dominio amino hacia el exterior celular y el dominio carboxilo hacia el interior (para interaccionar con la proteína G).
