Generalidades sobre la hemoglobina
La hemoglobina es una proteína indispensable para el transporte del oxígeno y del dióxido de carbono en la sangre en vertebrados y en algunos invertebrados. La hemoglobina más frecuente en los seres humanos adultos es la hemoglobina A (abreviada HbA). La molécula HbA está compuesta por cuatro subunidades, dos péptidos alfa y dos beta. Además de los dos genes que codifican para estos péptidos existen otros genes que codifican para subunidades diferentes de la hemoglobina. Estos genes forman la familia multigénica de la hemoglobina y todos tienen un antecesor común. Puedes leer más sobre la homología genética en el artículo que le dedicamos aquí. Existen dos familias de hemoglobinas, aquellas que derivan de la hemoglobina alfa y aquellas que se formaron a partir de la hemoglobina beta.
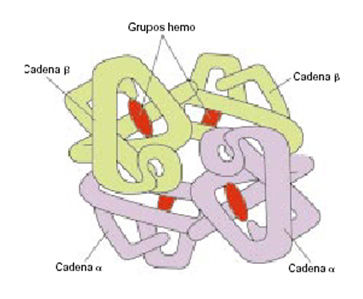
Imagen esquemática de la estructura cuaternaria de la hemoglobina con sus grupos hemo.
La hemoglobina es una molécula de peso molecular medio, con unos 64 kDa. La estructura cuaternaria de la hemoglobina está formada por las cuatro globinas que unen entre sí. Además a cada una de ellas se une un grupo hemo (un anillo de porfirina que alberga una molécula de hierro). Es precisamente esta molécula de hierro la que se enlazará con la molécula de oxígeno para transportarla por la sangre. Son precisamente estas moléculas de hierro del grupo hemo las que dan el color rojo de la sangre. En crustáceos y otros invertebrados que no tienen hemoglobina, está presente la hemocianina, una molécula similar con cobre en lugar de hierro como centro reclutador del oxígeno. Es por esto que estos animales presentan una sangre azulada y no roja.
Las cadenas alfa constan de 141 aminoácidos y las cadenas beta de 146 aminoácidos en los seres humanos, en otras especies este número puede variar. Aunque son parecidas en el número de aminoácidos su estructura primaria (la secuencia de aminoácidos) es diferente. Cada globina, la parte proteica de la hemoglobina, consta de una estructura secundaria típica. Las hemoglobinas alfa están formadas por 7 hélices alfa separadas por una secuencia de aminoácidos y las hemoglobinas beta presentan 8 hélices alfa. Las moléculas de hierro del grupo hemose sitúan entre dos hélices alfa.
La hemoglobina tiene una estructura terciaria globular y es soluble en agua. Se carga con oxígeno en los pulmones, donde el oxígeno molecular es capaz de entrar en los capilares. Cuando la hemoglobina está asociada al oxígeno, independientemente del tipo de hemoglobina que sea, se denomina oxihemoglobina. La hemoglobina oxigenada o arterial tiene un color rojo brillante debido a la unión del hierro con el oxígeno. Esta hemoglobina viajará por la sangre hasta los tejidos que necesiten oxígeno. En ellos, por cambios de presión parcial de oxígeno se liberará el oxígeno y las hemoglobinas podrán coger el CO2. La hemoglobina pierde el oxígeno, queda reducida, su color cambia a un color rojo oscuro y se denomina carboxihemoglobina.
La hemoglobina es una proteína de gran interés científico y médico. Le dedicaremos un artículo exclusivo a cómo une la hemoglobina el oxígeno y el dióxido de carbono y cómo lo libera en su tejido diana, léelo aquí.
