Métodos de estudio de la célula (IV)
Exploración funcional in situ.
Estos métodos permiten identificar y localizar los diferentes compuestos químicos de la célula mediante la utilización de colorantes, pero también permiten obtener fracciones subcelulares por centrifugación y detectar la actividad de cada una de las partes de la célula.
Citoquímica y extracciones selectivas.
Las coloraciones citoquímicas se realizan con colorantes que se unen selectivamente a ciertos grupos de moléculas como proteínas, lípidos, ácidos nucleicos y polisacáridos. La presencia de proteínas se determina con el verde rápido, que se une a los grupos básicos libres. Las proteínas que contienen tirosina se determinan por la reacción de Millón, en la que un reactivo nitroso-mercúríco reacciona con los grupos de tirosina dando un precipitado de color rojo. Las grasas se identifican con tetróxido de osmio, que las colorea de negro, o con el Sudán III que las colorea de rojo. Los polisacáridos de la pared vegetal (celulosa) con el verde metilo. El ADN y ciertos hidratos de carbono pueden ponerse de manifiesto con un reactivo para los grupos aldehído (reactivo de Schiff) que contiene fucsina básica tratada con anhídrido sulfuroso. Dentro de este grupo destacan la reacción de PAS y la de Feulgen.
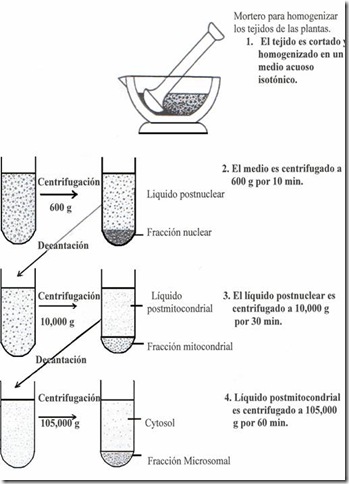
El fraccionamiento celular.
Consiste en romper las células por métodos físicos, lo que permite separar las fracciones subcelulares según su masa y peso específico. De este modo se pueden estudiar los diferentes orgánulos y estructuras subcelulares. El método más utilizado es la ultracentrifugación diferencial, mediante la cual se van depositando los distintos componentes celulares según la velocidad de sedimentación.
Citoenzimología.
En la célula, la presencia de una enzima determinada puede detectarse a partir de los productos de su actividad. Por ejemplo, si se trata de fosfatasas los tejidos son incubados en un medio que contiene un fosfato (sustrato) y una sal de plomo soluble. La presencia de la enzima da lugar a la liberación de fosfato y a la formación de un precipitado de fosfato de plomo que es opaco a los electrones.
Inmunocitoquímica.
Para localizar en la célula sustancias que posean propiedades antigénicas (proteínas, glucoproteínas) puede utilizarse su capacidad para formar complejos con los anticuerpos. Se inyecta una sustancia X a un animal (conejo, rata), los anticuerpos formados por el mismo (anti-X) se extraen y purifican. Estos anticuerpos son asociados a una molécula opaca a los electrones (ferritina) o a una enzima fácilmente detectable. En presencia de la sustancia X, el anticuerpo "marcado" forma con ella un complejo visible y detectable al microscopio electrónico.
Autorradiografía.
Cuando se da a una célula un metabolito marcado con un átomo radiactivo, la célula lo utiliza de la misma forma que utiliza al isótopo no radiactivo en sus procesos de síntesis. El átomo es incorporado en los componentes naturales de la célula y es utilizado como marcador. Generalmente se emplean precursores marcados con tritio. Como portador de este átomo se utiliza una molécula que pueda ser incorporada de forma específica en un complejo macromolecular (timidina para el ADN, uridina para el ARN, aminoácidos para proteínas, osas para los polisacáridos).
La detección de la radiactividad incorporada se lleva a cabo mediante aplicación de una emulsión fotográfica sobre el corte: las radiaciones emitidas por los átomos radiactivos impresionan la emulsión que, después, es revelada como una película fotográfica ordinaria. Los granos de plata metálica se localizan sobre las estructuras que han incorporado los átomos radiactivos.
