Métodos de estudio de la célula (III)
Técnicas de preparación
La obtención de una buena preparación es el resultado de un proceso, más o menos complicado, en el que se utilizan diversas técnicas como la fijación, inclusión, tinción y corte. Si la observación se realiza con células vivas es necesario utilizar colorantes que no sean nocivos para las mismas como el rojo neutro o el azul de metileno.
Pero es más frecuente realizar los análisis con las células muertas que conservan su morfología y composición química. Para ello se utilizan fijadores, soluciones que actúan sobre la parte proteica de la célula. La fijación tiene por finalidad consolidar las estructuras celulares, creando nuevas uniones intermoleculares de forma que las estructuras celulares se alteren lo menos posible. Las muestras que se preparan para el microscopio electrónico son fijadas con tetróxido de osmio.
Después de la fijación es necesario realizar, cortes finos que permitan la observación. Para ello se hace una inclusión que endurece la muestra y facilita el corte. Se utiliza parafina para la microscopía óptica y resinas para el microscopio electrónico.
El corte se hace con microtomos y ultramicrotomos.


Obtenida la muestra, ésta se coloca sobre un portaobjetos (una rejilla metálica en caso de utilizar el microscopio electrónico). Previa a la observación al microscopio óptico, se puede teñir el objeto para facilitar su observación.
Técnicas de tinción.
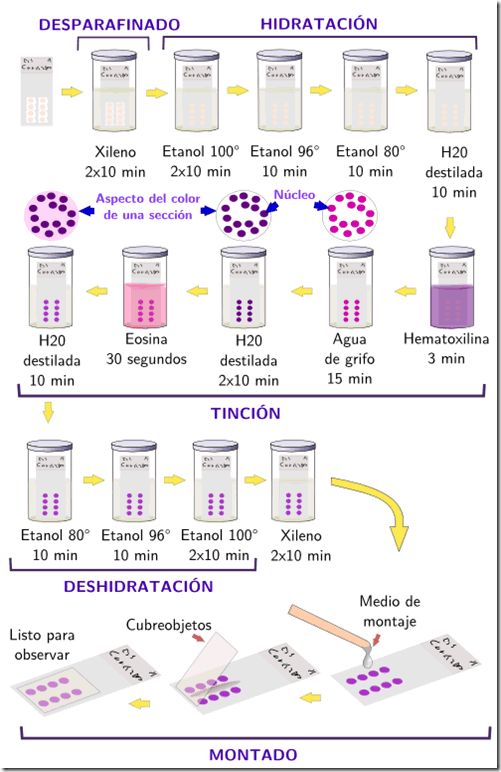 Para proceder con la tinción debemos en primer lugar retirar todo rastro de la parafina que hemos utilizado para endurecer la muestra y realizar el corte. Es del todo necesario pues la parafina es impermeable al agua y los colorantes que utilizamos sí son solubles en aguas. Por lo tanto, después del desparafinado procederemos a realizar una hidratación lenta, con varios pasos intermedios.
Para proceder con la tinción debemos en primer lugar retirar todo rastro de la parafina que hemos utilizado para endurecer la muestra y realizar el corte. Es del todo necesario pues la parafina es impermeable al agua y los colorantes que utilizamos sí son solubles en aguas. Por lo tanto, después del desparafinado procederemos a realizar una hidratación lenta, con varios pasos intermedios.
Es el momento de aplicar el colorante deseado. Se colocará la muestra dentro del colorante ( o una gota del colorante sobre la muestra si esta es pequeña) durante un tiempo suficiente, habitualmente entre 2 y 10 minutos. Procederemos a lavar el exceso de colorante. Si utilizásemos una tinción múltiple, es el momento de repetir estos últimos pasos con cada uno de los colorantes deseados. La muestra así queda teñida.
Existen diferentes tipos de colorante, que se suelen clasificar por su afinidad química: básicos (por ejemplo hematoxilina, se unen a estructuras ácidas), ácidos (como la eosina –se unen a partes básicas de la célula-) y neutros (son indiferentes y tiñen más o menos por igual todas las partes de la muestra).
La muestra está lista para su observación. Si deseamos que la preparación sea permanente y duradera, tendremos ahora que volver a deshidratar la muestra, pues las resinas que se utilizan para hacer el montaje definitivo son hidrófobas y además así preservamos nuestra preparación de la degradación por parte de diversos microorganismos.
El montaje se hace en un portaobjetos, cubriendo la muestra con el cubre objetos.
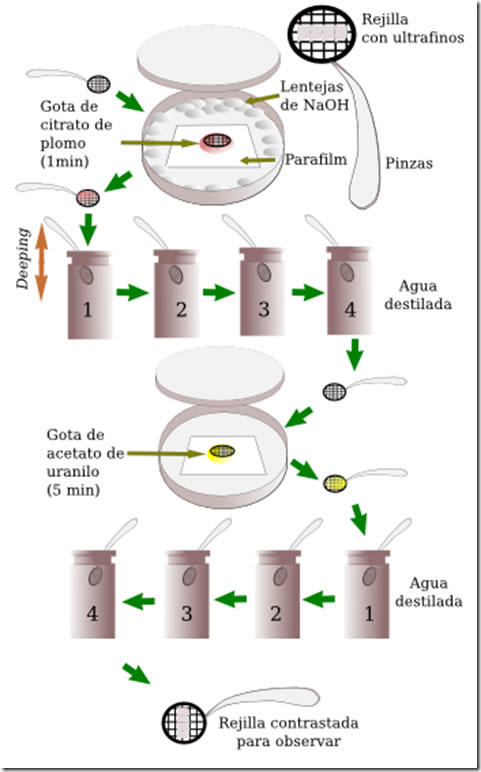
Para el caso de la microscopía electrónica el procedimiento es similar aunque no hablamos de tinción sino de contraste, pues lo que buscamos no son diferencias de color en distintas partes de la preparación sino que unas zonas sean opacas a los electrones y otras transparentes. Solemos utilizar sales de metales pesados.
Criofractura
El material se endurece por congelación rápida a -150 °C en nitrógeno líquido. Los bloques son fracturados en vacío y expuestos mediante sublimación de la cubierta superficial de hielo: el plano de fractura corresponde siempre a las zonas de menor resistencia (membranas). Mediante vaporización con carbono y metales puede obtenerse una réplica (molde) de la superficie fracturada. Las estructuras orgánicas son disueltas, por lo cual, lo que se observa es una réplica.
Mediante esta técnica puede evitarse la fijación química, con lo que hay menos riesgos de desnaturalización de las estructuras. Se aplica a muchos tipos de muestras, pero sólo permite un estudio morfológico.
