Una introducción a los estados Redox
En la naturaleza es extraño encontrar moléculas que no presenten ningún tipo de carga, entre los elementos solo los gases nobles pueden estar libres sin asociación con otros elementos y no presentar carga, el resto de los elementos tiende a enlazarse para formar moléculas estables mediante el equilibrio de las cargas eléctricas. Por ejemplo, las formas más comunes de hidrógeno, presentan carga positiva y las del oxígeno carga negativa, de tal manera que dos moléculas de hidrógeno se unen con una de oxígeno para equilibrar sus cargas, formando el agua. Con las moléculas orgánicas pasa algo similar.
En bioquímica se conocen como reacciones redox o de reducción oxidación a aquellas reacciones químicas que incluyen una transferencia de electrones de una molécula que cede un electrón (donadora) a otra molécula, la receptora. En estas reacciones la energía con la que se lleva a cabo el trabajo se denomina energía libre de Gibbs (en honor al físico estadounidense que postuló la existencia de esta fuerza termodinámica).
Las moléculas que pueden ceder electrones, tienen carga negativa, se denominan donadoras y tienen poder reductor. Por el contrario las moléculas que tienen carga positiva pueden aceptar electrones, por lo que son las moléculas aceptoras y se dice que están oxidadas (cuando a una molécula de un metal, que tienen siempre carga positiva, se le une una molécula de oxígneo, se oxida perdiendo energía en la unión).
Además, es importante entender que los procesos redox no son exclusivos de la bioquímica. En la química general, también se observan reacciones redox en las que se transfieren electrones. Estas reacciones son fundamentales para muchos procesos industriales y naturales, como la corrosión de metales, la producción de electricidad en baterías y la fotosíntesis en las plantas.
A pesar de que es posible que una transferencia de electrones ocurra de manera aislada en los seres vivos el transporte de la energía se intenta aprovechar al máximo enlazando sucesivas reacciones que van transportando el electrón desde moléculas de alta energía a moléculas de menor energía sucesivamente. Cuando la energía en forma de los electrones se transfiere entre sucesivas reacciones de forma que el electrón va de una molécula altamente energética (con poder reductor) a una de bajo poder reductor (oxidada) se forma lo que denominamos una cadena de transporte, como la cadena de tranporte de electrones que ocurre en las mitocondrias de la que puedes leer más en el artículo que le dedicamos aquí u otro ejemplo de cadena de transporte sería el ciclo de Krebs, del que puedes leer más en los artículos que le dedicamos aquí y aquí.
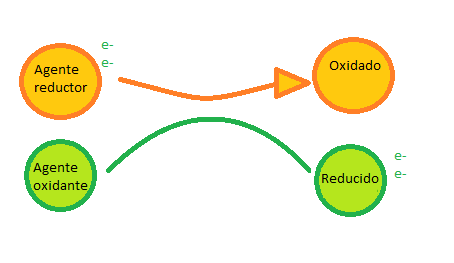
En los seres vivos se acoplan los procesos de oxidación con los de reducción para no perder la energía.
Estos cambios de energía no se dan de forma espontánea en los seres vivos los enzimas son los encargados de catalizar estas transferencias mediante la aproximación de las moléculas implicadas y muchas veces actuando como intermediarios energéticos de la reacción. Sin embargo el transporte de los electrones siempre se lleva a cabo a favor de un gradiente energético (de moléculas de más energía a moléculas menos cargadas). Pero entonces, ¿cómo se crean las moléculas de alto valor energético como el ATP? Pues acoplando su síntesis a reacciones que liberan energía y son termodinámicamente favorables. Por ejemplo en el ciclo de Krebs la formación de moléculas con poder reductor (como el NADH) está asociada a reacciones de oxidación de sustratos, que ceden la energía a estas moléculas.
Estas moléculas con poder reductor o de alto valor energético como son la adenosina trifosfato (ATP) o la nicotinamida adenina dinucleótido (NADH) que se forman durante el metabolismo degradativo (anabolismo) de los nutrientes son empleadas después por las células para la síntesis (catablismo) de otras moléculas a las que transfieren su energía.
En el contexto de la biología celular, las reacciones redox juegan un papel crucial en la producción de energía. En la respiración celular, por ejemplo, las células utilizan oxígeno para oxidar la glucosa y producir ATP, una molécula que almacena energía para su uso posterior. Este proceso es esencial para la vida, ya que proporciona la energía necesaria para todas las funciones celulares, desde la contracción muscular hasta la síntesis de proteínas.
Por último, es importante destacar que las reacciones redox también son fundamentales para el sistema inmunológico. Los glóbulos blancos, por ejemplo, producen radicales libres de oxígeno para matar bacterias y otros patógenos. Estos radicales libres son moléculas altamente reactivas que pueden oxidar y dañar las células y las moléculas, por lo que su producción debe ser cuidadosamente regulada para evitar daños a las propias células del cuerpo.
