Los enzimas y sus propiedades. Introducción.
La mayor parte de las reacciones químicas que tienen lugar en la célula (de facto prácticamente todas) se hacen posibles gracias a los enzimas (antiguamente también llamados fermentos), que son biocatalizadores fabricados por las mismas células y gracias a los cuales aumenta considerablemente la velocidad de las reacciones químicas.Esta transformación se produce ya que los enzimas reducen considerablemente la energía de activación de las reacciones biológicas.
Por ejemplo, laas transformaciones que sufren los alimentos en el tubo digestivo se deben a la acción de los enzimas digestivos que se vierten en dicho tubo.
Del mismo modo que los catalizadores inorgánicos, los enzimas participan en las reacciones químicas, pero no en los productos finales de la reacción. Quiere decir esto que no se consumen en la propia reacción.
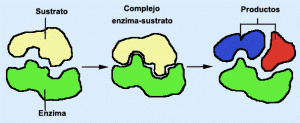
La especificidad es un carácter importante de la acción enzimática, en virtud de la cual cada enzima sólo actúa sobre una sustancia (sustrato) o grupo de sustancias afines; así, la sacarasa únicamente actúa sobre la sacarosa. En cambio, otros enzimas tienen especificidad para un enlace químico determinado, propio de todo un conjunto de sustancias, como las proteasas, que hidrolizan las proteínas actuando sobre el enlace peptídico.
Los enzimas no son los que inician la reacción, sino sus activadores. La reacción puede realizarse sin su intervención, aunque entonces con lentitud extrema; así, la saponificación se da espontáneamente en las grasas neutras, pero en proporción muy débil; en cambio, la lipasa acelera extraordinariamente el proceso.
La acción enzimática, como corresponde a un catalizador, es en muchos casos reversible; por eso, la maltasa, que desdobla la maltosa en dos moléculas de glucosa, puede sintetizar maltosa a partir de la glucosa.
Propiedades fisicoquímicas de los enzimas.
Puesto que la mayoría de los enzimas son proteínas, sus propiedades serán las mismas. Son solubles en el agua y se precipitan por el alcohol. Cada enzima tiene un pH óptimo de actividad. Por ejemplo la pepsina del estómago ha de actuar en medio ácido y la tripsina del jugo pancreático en medio alcalino. La temperatura también incfluye sobre las acciones enzimáticas; las bajas temperaturas las inactivan, pero no las destruyen. Conforme se aumenta la temperatura crece su actividad hasta un valor óptimo, a partir del cual decrece y, finalmente, a temperaturas altas, se destruyen. Los enzimas de los animales homotermos (aves y mamíferos) tienen su óptimo entre los 36° y los 41 ° C.
Constitución de los enzimas.— Son sustancias proteicas complejas y en muchas ocasiones están formadas por una parte proteica llamada apoenzima y por un grupo activo llamado coenzima. Mucho de los coenzimas son para nosotros, los seres humanos, vitaminas. Es decir no podemos sintetizarlos y hemos de incorporarlos con la dieta.
Clasificación de los enzimas. En la actualidad se consideran seis grupos de enzimas:
- Oxidorreductasas: catalizan reacciones de oxidorreducción o redox. Precisan la colaboración de las coenzimas de oxidorreducción (NAD+, NADP+, FAD) que aceptan o ceden los electrones correspondientes.
- Transferasas: transfieren grupos funcionales entre diversas moléculas.
- Hidrolasas: catalizan reacciones de hidrólisis, es decir, de ruptura de enlaces mediante la introducción de moléculas de agua.
- Liasas: catalizan reacciones en las que se eliminan grupos H2O, CO2 y NH3 para formar un doble enlace
- Isomerasas: Isomerizan moléculas.
- Ligasas: se encargan de la formación y destrucción de enlaces mediante el gasto de energía mediada por el ATP.