El enlace peptídico
El grupo carboxilo de un aminoácido puede interaccionar con el grupo amino de otro, quedando unidos ambos aminoácidos y liberándose una molécula de agua. El enlace formado se denomina enlace peptídico y el compuesto así obtenido se denomina dipéptido.
El mecanismo de esta reacción es el siguiente:
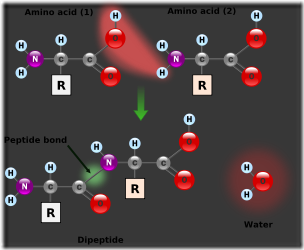
El grupo carboxilo del primer aminoácido se combina con el grupo amino del segundo y se libera una molécula de agua, quedando formando el dipéptido correspondiente.
La atracción entre el grupo carboxilo y el grupo amino permite su unión y la formación de una molécula de agua, que se libera. Quedan, entonces, el átomo de carbono del grupo carboxilo y el nitrógeno del grupo amino, con valencias libres que emplean para unirse entre sí.
Se trata de un proceso de condensación semejante al que tiene lugar entre los monosacáridos o en la formación de los lípidos saponificables.
El enlace creado es de tipo amida y se denomina enlace peptídico. A su vez, este enlace puede ser hidrolizado separándose los dos aminoácidos.
El enlace peptídico se estabiliza porque los átomos de carbono, oxígeno y nitrógeno comparten electrones, lo que hace que aparezcan dos formas resonantes
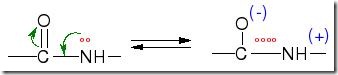
Las formas resonantes tiende a configurar enlaces muy resistentes como es el caso que nos ocupa. Enlace carbono-nitrógeno del grupo peptídico tiene un carácter parcial de doble enlace, lo que hace que el grupo de átomos que participa en él sea plano. Se puede afirmar, por tanto, que el enlace peptídico tiene un carácter parcial de doble enlace.
Este hecho impide que se efectúen torsiones alrededor del enlace peptídico, lo que determina que los átomos de carbono, oxígeno y nitrógeno se sitúen en el mismo plano.
El dipéptido puede unirse a otro-aminoácido, pues sigue teniendo un grupo carboxilo y un grupo amino libres. En la unión se liberaría otra molécula de agua y se formaría un tripéptido. De nuevo, éste podría seguir adicionando nuevos aminoácidos y dar lugar a tetrapéptidos, pentapéptidos, etc. La unión de muchos aminoácidos constituye un polipéptido.
Se puede observar que en los enlaces peptídicos no participan los radicales de los aminoácidos, que quedan «colgando» del polipéptido.
Péptidos de interés biológico.
Existen algunos péptidos cortos con función biológica. Entre ellos podemos citar el tripéptido glutatión (que actúa como transportador de hidrógeno en algunas reacciones metabólicas), los nanopéptidos oxitocina y vasopresina (con actividad hormonal) o los decapéptidos tirocidina, gramicidina y valinomicina (antibióticos).
En algunos de ellos existen D-amino-ácidos que pueden ser cíclicos y en cuyos enlaces peptídicos pueden intervenir grupos carboxilo de las cadenas laterales.
En alimentación se están estudiando algunos péptidos que tienen efectos interesantes y que se han venido en denominar “péptidos bioactivos”.
Efectos de los péptidos bioactivos:
- Efectos sobre el sistema digestivo: Se han aislado péptidos con actividad opiácea y que actúan como moduladores exógenos de la motilidad gastrointestinal, permeabilidad intestinal y liberación de hormonas intestinales, por ejemplo las casomorfinas.
- Efectos inmunomoduladores y antimicrobianos: por ejemplo el Met-enkephalin, que altera la respuesta inmune y retrasa la respuesta de hipersensibilidad cutánea. Como ejemplo de actividad antimicrobiana, podemos citar a la isracidina.
- Péptidos con efectos sobre el sistema cardiovascular con actividad anti hipertensiva derivados de la caseína de la leche.

