Epigénesis y epigenética
La epigenética es una rama de la biología que parece tomar más importancia a medida que se conoce más sobre la regulación de la transcripción. Su primera definición moderna por Conrad Waddington implicaba el estudio de las interacciones entre los genes y sus productos que dan lugar a un fenotipo. No obstante, esta definición ha quedado obsoleta puesto que se ha afinado el ámbito de su estudio. Actualmente se define como cualquier cambio en la cromatina que no implique cambios en la secuencia del ADN y que puede perdurar durante una o más generaciones [Boyko y Kovalchuk, 2008]. Si el ADN contiene la información necesaria para la expresión de todas las proteínas y ARNs necesarios para la señalización, síntesis y organización de todos los compuestos necesarios para la supervivencia del ser vivo, la epigenética son los factores que modulan la expresión de dichos genes.
La epigenética comprende pues un gran número de modificaciones, con mecanismos de acción muy variados. Los más estudiados son la metilación del ADN, los cambios covalentes y no covalentes de las histonas y el ARN no codificante.
La metilación del ADN: la actividad citosina-metiltransferasa cataliza la transferencia de un grupo metilo activado desde S-adenosil metionina a la posición 5’ del anillo de citosina. La metilación del ADN es el proceso de epigenética más importante en eucariotas. En mamíferos, la metilación del ADN ocurre, casi exclusivamente, en residuos de citosina, en las llamadas islas CpG, mientras que en plantas la metilación puede ocurrir en CpG, CpNpG y CpNpH (donde H es A, T, o C). El efecto de esta metilación en los residuos de citosina del ADN es, por lo general, el silenciamiento de los genes en los que ocurre. Cabe destacar que son necesarias muchas metilaciones a lo largo de la cadena de un gen para que este quede silenciado, y su expresión, por lo tanto, quede reducida o parada. Además, la metilación del ADN juega un papel crucial en procesos biológicos como la inactivación del cromosoma X en mamíferos, la impronta genómica y la defensa contra elementos transponibles.
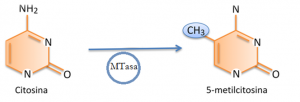
La enzima ADN metiltransferasa (MTasa) metila la citosina de la cadena de ADN para silenciar la expresión de muchos genes.
Cambios covalentes y no covalentes de las histonas: las histonas son las proteínas sobre las que el ADN de los eucariotas se enrolla dentro del núcleo cuando no se está transcribiendo. El extremo amino-terminal de estas proteínas queda expuesto de tal manera que sus aminoácidos pueden ser modificado de forma covalente, más duradera, o no covalente, generado por fuerzas más transitorias. Las modificaciones más comunes ocurren en los aminoácidos lisina y arginina, de los cuales es muy rica la cola. La metilación, normalmente, crea una unión más estrecha entre el ADN y la histona, de tal manera que dificulta la transcripción de esa parte del ADN. La acetilación por otra parte, frecuentemente relaja esta unión permitiendo la entrada de proteínas necesarias para empezar la transcripción.
Pero existen muchas más modificaciones de las histonas: fosforilación, deaminación, isomerización de prolinas y ubiquitinización. El comportamiento final de las histonas es la suma de varias de estas modificaciones que actúan de forma sinérgica. Además, las modificaciones de las histonas no solo afectan la transcripción, sino también otros procesos como la reparación del ADN, la replicación y la condensación de los cromosomas durante la mitosis y la meiosis.
Por último, el ARN no codificante controla mediante una unión homóloga débil, con una de las dos hebras de ADN su expresión. En la actualidad existen muchos grupos científicos dedicados a encontrar pequeños ARNs, de unas 21-24 pb, que podrían estar regulando negativamente la expresión de proteínas. Estos pequeños RNA producidos durante la transcripción del ADN podrían unirse a una de las cadenas del ADN o de ARN de su gen de origen o de otros genes por homología de bases. El efecto de la unión de estos ARNs es negativo para la expresión de la hebra a la que se unen. Entre los ARN no codificantes más estudiados se encuentran los microARNs (miARNs) y los ARN largos no codificantes (lncARNs). Los miARNs pueden degradar el ARN mensajero (ARNm) o inhibir su traducción, mientras que los lncARNs pueden interactuar con proteínas y otros ARN para regular la expresión génica a múltiples niveles.
La epigenética no solo es crucial para el desarrollo y la diferenciación celular, sino que también está implicada en diversas enfermedades. Alteraciones en los mecanismos epigenéticos pueden llevar a enfermedades como el cáncer, trastornos neurológicos y enfermedades metabólicas. Por ejemplo, la hipermetilación de genes supresores de tumores puede contribuir a la progresión del cáncer, mientras que la desregulación de miARNs está asociada con enfermedades neurodegenerativas como el Alzheimer.
En el ámbito de la medicina, la epigenética ofrece nuevas oportunidades para el desarrollo de terapias. Los inhibidores de la ADN metiltransferasa y los inhibidores de las histonas desacetilasas son ejemplos de fármacos epigenéticos que se están utilizando en el tratamiento de ciertos tipos de cáncer. Además, la reversibilidad de las modificaciones epigenéticas sugiere que podrían ser objetivos terapéuticos efectivos para una variedad de enfermedades.
