Rubisco
La Rubisco es la enzima que se dice que es la más abundante en masa del planeta Tierra. La rubisco, cuyo nombre completo es ribulosa-1,5-bisfosfato carboxilasa oxigenasa es una proteína de cloroplastos imprescindible para la fijación del dióxido de carbono (CO2) atmosférico. Este complejo proteico es exclusivo de los tejidos verdes de vegetales y de aquellos organismos que realicen la fotosíntesis.
A lo largo de la evolución, la Rubisco ha mantenido una presencia fundamental en la fotosíntesis, lo que ha permitido que las plantas y algunos microorganismos utilicen la energía solar para fijar el carbono. A pesar de su relativa ineficiencia, la presión evolutiva no ha favorecido variantes más rápidas, posiblemente debido a las complicaciones estructurales y la necesidad de mantener un equilibrio entre velocidad y especificidad.
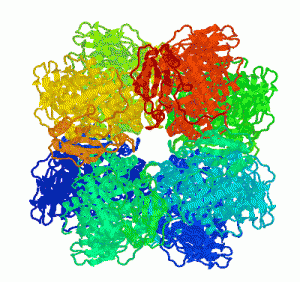
La forma cristalizada de la Rubisco deja ver perfectamente la forma de tonel hueco que la caracteriza.
Estructura: El complejo funcional completo de la rubisco es extraordinariamente grande. La Rubisco está formada por dos subunidades. La subunidad mayor pesa unos 54 KDa y la pequeña alrededor de 14KDa, con 475 y 123 aminoácidos respectivamente. Los estudios de la Rubisco en plantas superiores revelan que estas subunidades forman un complejo de 8 subunidades mayores y 8 subunidades menores. Las subunidades mayores se agrupan en dímeros de tal forma que los centros catalíticos quedan entre ambas subunidades. Para adoptar la conformación final de la rubisco cuatro dímeros de subunidades mayores se agrupan formando un barril con los centros catalíticos en el centro. Después a este barril se le unirán las 8 subunidades menores por los extremos, dejando un hueco en el eje central del barril. Por otro lado, en bacterias la Rubisco no forma estos complejos tan grandes, sino que tan solo está formado por un dímero de subunidades muy parecidas a la unidad mayor del complejo.
Existen distintas variantes de la Rubisco, presentes en diferentes organismos como cianobacterias y algunas algas. Estas formas diversificadas presentan diferencias en su conformación proteica que afectan sus tasas catalíticas y afinidades por el CO2 y O2, influenciadas por la adaptación al entorno en que se desarrollan.
La subunidad mayor está dividida en dos dominios, denominados N-terminal y C-terminal, que tiene 150 aminoácidos y 325 aminoácidos respectivamente. El dominio N-terminal está formado por el primer tercio de la cadena y no codifica el centro catalítico de la enzima. Por el otro lado el dominio Carboxi-terminal es el que participa del barril tanto estructural como catalíticamente. Este barril, formado por las 8 subunidades presenta 8 hélices alpha en el exterior del barril y 8 láminas beta en el interior del barril, todas ellas emparejadas de dos en dos. Los aminoácidos catalíticos son Lys 201, Asp 202, Asp 203 y Glu204.
Función: la rubisco es esencial para la vida autótrofa en la que se basa la pirámide alimentaria de nuestro planeta. Como ya hemos comentado es imprescindible en la fijación del carbono atmosférico para convertirlo en carbono orgánico, puesto que es el primer paso del proceso denominado ciclo de Calvin.
Esta proteína une covalentemente el CO2 al azúcar ribulosa-1,5-bisfosfato, de 5 carbonos, este glúcido inestable es roto en dos moléculas de 3-fosfoglicerato, que serán incorporados a los ciclos de obtención de energía y materia orgánica del ser vivo, mediante la entrada del fosfoglicerato en la glucolisis o la formación de azúcares más complejos.
La Rubisco tiene además otra actividad, la oxigenasa, que compite con la carboxilasa por el centro catalítico. Esta fijación de oxígeno (O2) se denomina fotorespiración y puesto que el oxígeno es más abundante que el CO2 en la atmósfera esta actividad está favorecida. Sin embargo, la rubisco es capaz de coger 3 o 4 moléculas de CO2 por cada una de O2. Esta ineficacia además del enorme gasto energético que supone (18 ATP y 12 NADPH) es lo que lleva a muchos biólogos y agrónomos a intentar mejorarla para obtener un mejor rendimiento agrícola.
La Rubisco está sujeta a regulación a través de la Rubisco activasa, una enzima que modula su actividad desactivando inhibidores en el sitio activo. Este proceso regulativo es crítico bajo condiciones fluctuantes de luz y temperatura, destacando su importancia en la respuesta adaptativa de las plantas ante cambios ambientales.
En los últimos años, la ingeniería genética ha buscado mejorar la eficiencia de la Rubisco. La inserción de genes de variantes más eficientes de organismos como las algas en cultivos ha sido un enfoque para mejorar el rendimiento agrícola frente a condiciones climáticas desafiantes.
En el contexto ecológico, la Rubisco es clave en los ciclos de carbono globales, al convertir CO2 en compuestos orgánicos, lo que sustenta la vida vegetal. En la agricultura, optimizar la función de la Rubisco podría incrementar la productividad de cultivos, contribuyendo a la seguridad alimentaria en un mundo en constante cambio climático.
