Biomoléculas orgánicas y química del carbono
Las biomoléculas orgánicas, glúcidos, lípidos, prótidos y ácidos nucleídos, se caracterizan por la presencia de átomos de carbono que se unen entre sí y a otros bioelementos, sobre todo a hidrógeno y oxígeno.
Estas son las moléculas que mejor caracterizan a la materia viva, a los organismos, y de ahí su nombre. Sin embargo, muchas de las que se llaman sustancias orgánicas no forman parte de la materia viva. Tanto unas como otras son objeto de estudio de la química del carbono (llamada tradicional e impropiamente química orgánica), algunos de cuyos conceptos elementales vamos a repasar.
El átomo de carbono.
El carbono es un átomo tetravalente, es decir, puede actuar formando hasta cuatro enlaces covalentes. Cada una de sus valencias puede estar ocupada por un átomo al que se une por enlace covalente sencillo. Recordemos que los enlaces covalentes se forman por la “compartición” de un par de electrones.
Además se comporta como si ocupara el centro de un tetraedro cuyos cuatro vértices corresponden a sus cuatro valencias. Esto hace que las moléculas orgánicas tengan “forma”, una estructura tridimensional, que será de vital importancia en las reacciones biológicas.
El metano puede ilustrar esta idea, como forma de molécula orgánica más simple.
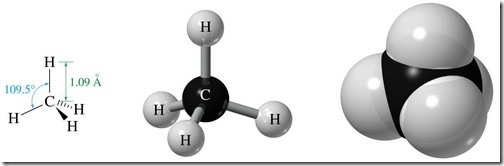
Observando la imagen vemos que los enlaces forman entre sí ángulos de 109,5 grados y los núcleos atómicos están separados 1,09 angstroms.
Estas geometrías se explican por la hibridación del carbono: sp3, tetraédrica con ángulos ~109,5°, sp2, plana trigonal con ~120°, sp, lineal con 180°. Los enlaces sencillos son de tipo sigma, mientras que en dobles y triples aparece uno o dos enlaces pi, que restringen la rotación.
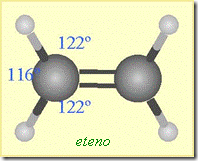
Si dos o tres valencias se ocupan en la unión con un mismo átomo, se forman dobles o triples enlaces covalentes y se pierde la figura tetraédrica. Cuando hay enlaces dobles, la forma de la molécula es plana y los ángulos de enlace son de aproximadamente 120 grados.
La presencia de C=C introduce isomería geométrica, cis y trans, describible como E y Z según prioridad. La rotación queda impedida por el enlace pi. También existe isomería óptica cuando un carbono es quiral, con cuatro sustituyentes distintos, muy común en biomoléculas. Los aminoácidos proteicos son L y muchos azúcares biológicos son D.
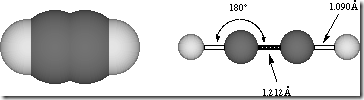
Los enlaces tripes son muy raros en las moléculas biológicas y su estructura es lineal.
La mayoría de los enlaces en las moléculas orgánicas con sencillos. Consideramos. pues la forma tetraédrica. Estos tetraedros tienden a unirse lateralmente a otros formando largas cadenas, bien lineales, ramificadas o cerradas en forma de anillos.
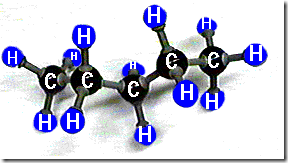 Cadena lineal
Cadena lineal
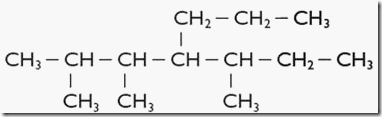 Cadena ramificada
Cadena ramificada
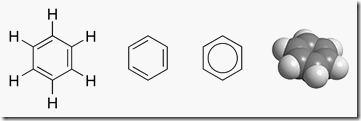 Cadena cíclica (cerrada o “en anillo”)
Cadena cíclica (cerrada o “en anillo”)
Algunas cadenas cíclicas presentan aromaticidad, característica de anillos planos y conjugados con 4n+2 electrones pi, según la regla de Hückel. El benceno es el ejemplo clásico. Anillos aromáticos aparecen en residuos de fenilalanina, tirosina y triptófano, y confieren estabilidad y apilamiento.
Las más frecuentes son las cadenas lineales hidrocarbonadas, propias de los hidrocarburos. En ellas los carbonos pueden unirse por enlaces sencillos y el resto de las valencias estar ocupadas por hidrógenos (cadenas saturadas) o pueden faltar hidrógenos y formarse dobles o triples enlaces (cadenas insaturadas).Estas series reciben nombres específicos, alcanos para cadenas saturadas con enlaces sencillos, alquenos cuando hay dobles y alquinos si existen triples. La longitud de la cadena y la ramificación originan numerosos isómeros de constitución, con propiedades físicas diferenciadas, como el punto de ebullición.
Pero los sustituyentes en los enlaces de carbono no tiene por qué limitarse al hidrógeno. Aparecen así los llamados grupos funcionales, es decir, un grupo específico de átomos unidos de forma característica que determinan las propiedades del compuesto donde se encuentran.
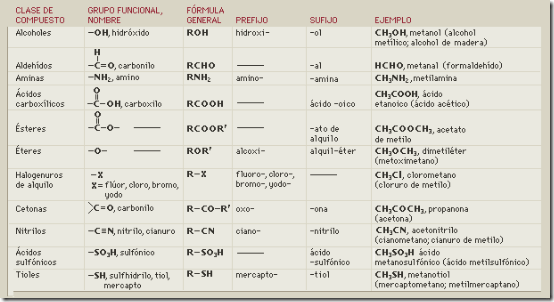
En la tabla siguiente se representan algunos grupos funcionales de la Química Orgánica que interesa conocer en Biología. Representamos con R- el resto de la molécula a la que se une el grupo funcional para constituir la función química, es decir, la serie de moléculas que, por tener en común ese grupo funcional, presentan propiedades parecidas.
Conviene asociar algunos grupos a funciones biológicas, hidroxilo en azúcares y alcoholes, carbonilo en aldehídos y cetonas, carboxilo en ácidos orgánicos, amino en aminoácidos, fosfato en nucleótidos y sulfhidrilo en cisteína. Enlaces éster, glucosídico, peptídico y fosfodiéster unen biomoléculas por condensación y se rompen por hidrólisis.