Síntesis de insulina
La insulina es una de las hormonas más importantes para nuestra vida diaria, puesto que nos permite metabolizar los nutrientes (sobre todo el anabolismo de los azucares). Fue descubierta por los doctores Frederick Grant Banting, Charles Best, James Collip, y J.J.R. Macleod en el año 1922. EL Dr. Banting fue galardonado con el premio Nobel por su descubrimiento, aunque después se demostró que su descubiertos fue Nicolae Paulescu.
Su importancia radica en que es la única hormona hipoglucemiantes: disminuye los niveles de glucosa en sangre. Se produce en las células beta del páncreas, concretamente en los islotes de Langerhans. Es un polipéptido formado por dos cadenas de aminoácidos unidas por dos puentes disulfuro (S-S). La cadena A de 21 aa. y la cadena B de 30 aa. Además aparece un puente S-S entre las cadenas (intracatenario).
Síntesis de insulina: esta proteína, como todas las proteínas, se sintetiza en los ribosomas, el paso de ARN a proteína genera una cadena de aminoácidos que llamamos preproinsulina, puesto que todavía tiene que ser procesada para ser funcional (sintetizar las proteínas no activas es un mecanismo muy común, cuya finalidad es poder almacenar una gran cantidad de proteína para poder activarla y liberarla rápidamente en el momento de recibir la señalización de que son necesarias). La preproinsulina pasa al REL donde es procesada, pierde un trozo de la cadena de aminoácidos del extremo C Terminal, transformándose en proinsulina, que presenta 3 cadenas: B-C-A donde la cadena C une a las otras dos.
Es en este punto en el que se forman los puentes disulfuro S-S. Siguiendo el camino habitual de la síntesis y procesado de proteínas la proinsulina pasa al Golgi donde irá adquiriendo una estructura más estable y al salir del Golgi se empaquetará en vesículas de secreción listas para salir de la célula, aunque todavía en forma de proinsulina. Es en las primeras vesículas, las vesículas recubiertas de clatrina que se desprenden del Golgi, donde comienza la escisión del péptido C. estas vesículas tienen en su membrana las bombas de protones que introducen H+ que produce una bajada del pH dentro de la vesícula, esto estimula la activación de las peptidasas (enzimas )presentes en la vesícula, y cuyo objetivo es escindir el péptido C transformando la proinsulina en insulina madura, lista para actuar. Las vesículas van perdiendo su cubierta de clatrina hasta transformarse en vesículas no recubiertas, que son las que presentan una mayor cantidad de insulina madura. Ésta se vierte al torrente sanguíneo por exocitosis.
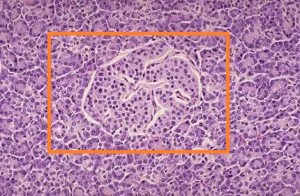
Recueadrado un islote de Langerhans, donde se encuentran las células beta que sintetizan la insulina.
Regulación de la síntesis de insulina:
Su síntesis se ve activada por altas concentraciones de glucosa en sangre, detectada por las propias células beta. La respuesta primera es la secreción rápida de insulina. Secundariamente se activa la síntesis para generar nueva preproinsulina. Además la arginina, algunos ácidos grasos, hormonas gastrointestinales y el propio Sistema nervioso parasimpático pueden activar su síntesis o su liberación.
Por otra parte su síntesis se ve inhibida por catecolaminas (como la adrenalina), que son estimuladas por el sistema nervioso simpático, el cual actúa en situaciones de estrés en las que hace falta tener glucosa disponible (la glucosa es la molécula energética preferida por el organismo, siendo la de más rápida degradación y muy accesible por el torrente sanguíneo). Es por eso que en estas situaciones en las que es importante tener glucosa en sangre no conviene tener insulina, que la conduce a la formación de glucógeno y glucolisis.
Lee como se hace la insulina transgénica aquí
