Fosfatasa
Se engloban dentro del grupo de las fosfatasas todas aquellas enzimas que presenten actividad hidrolasa capaz de eliminar un grupo fosfato inorgánico a un sustrato. Dicho sustrato puede ser bien otra proteína u otro compuesto orgánico aminoacídico o bien un nucleótido. Al proceso bioquímico de la escisión de un fosfato se le denomina desfosforilación. A la actividad contraria se la denomina fosforilación y es llevada a cabo por las enzimas denominadas quinasas o cinasas, de las que puedes leer más en nuestro artículo aquí (próximamente).
La fosforilación y desfosforilación de sustratos es un mecanismo clave del control bioquímico celular. En general la desfosforilación de un sustrato, sea una proteína, un glúcido o una molécula de ADN, supone la inactivación del sustrato. Durante la evolución de la bioquímica celular se ha llegado al consenso de que los sustratos fosforilados son compuestos activos, mientras que los que no tienen fosfato son menos reactivos. Esto es debido a que el enlace fosfoéster que une el fosfato inorgánico con el sustrato contiene mucha energía bioquímica. El ATP y otras moléculas de almacenamiento de energía bioquímica son un sustrato de las fosfatasas que suelen ceder el fosfato a otra molécula que se quiere activar.
En la clasificación numérica de los enzimas basada en su actividad, el número EC (del inglés Enzyme Commission numbers) son las 3.1.3, es decir aquellas hidrolasas “3” , por ser una enzima que usa el agua para catalizar la reacción, “1” por ser hidrolasas que rompen enlaces de tipo éster y “3” por ser aquellas cuyo producto final es un monoéster fosfórico. Se han descrito hasta la fecha unas 85 fosfatasas diferentes. Algunas de ellas se han encontrado en todos los seres vivos, como por ejemplo la fosfatasa alcalina (EC 3.1.3.1) o la ácida (EC 3.1.3.2). Las fosfatasas ácidas son aquellas que funcionan mejor en medios con pH ácido, lee más de ellas en su artículo aquí (próximamente). Por el contrario las fosfatasas alcalinas actúan de una manera más eficiente en medios cuyo pH sea básico. Lee más de este tipo de fosfatasas aquí (próximamente). El nivel de fosfatasas alcalinas se utiliza como prueba rutinaria en los análisis de sangre para determinar posibles problemas de hígado, óseos o de desnutrición.
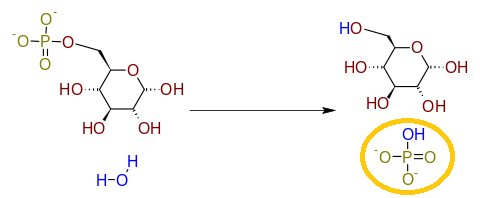
Actividad de la glucosa-6-fosfato.
Aunque también la glucosa-6-fosfatasa (EC 3.1.3.9) o la fosfoserina fosfatasa (EC 3.1.3.3) o la piruvato kinasa fosfatasa (EC 3.1.3.49) están presentes en todos los organismos. Algunas de ellas se conocen perfectamente en seres humanos como la fosfatasa antitumoral PTEN (EC 3.1.3.67) que desfosforila los residuos de tirosina, serina y treonina de las proteínas; además de quitar el grupo fosfato de lípidos (actividad lípido-fosfatasa), que interviene en la regulación del ciclo celular. Al revés que otras enzimas algunas de las fosfatasas necesitan estar desfosforiladas para ser activas. Esto tiene sentido si se piensa en las condiciones citoplasmáticas que en las que es importante que actúen estos enzimas, es decir, en aquellas donde los niveles energéticos son bajos y es necesario liberar energía mediante la rotura de enlaces fosfato. Muchas enzimas fosfatasas necesitan cofactores para su actividad, como pueden ser iones calcio o iones magnesio, por lo que niveles bajos de estos compuestos pueden interferir negativamente en el metabolismo celular debido al malfuncionamiento de estas enzimas.
