El agua: propiedades químicas
Comentábamos en un artículo anterior que el agua es una molécula muy abundante en los seres vivos, formada por hidrógeno y oxígeno. Hemos estudiado su forma y una propiedad fundamental: el agua es un dipolo.
Esto quiere decir que presenta una región, la del oxígeno, con una ligera carga negativa (diferencial de carga negativa) y otra zona, la de los hidrógenos, con una diferencial de carga positiva. Como veremos en este artículo de esta propiedad química se van a deriva las propiedades bioquímicas más importantes de la molécula.
El papel del agua en la regulación de la temperatura
El agua juega un papel central en la regulación de la temperatura en ambientes tanto naturales como biológicos. Debido a su elevado calor específico, puede absorber y liberar grandes cantidades de calor con mínimas variaciones de temperatura. Esto estabiliza las temperaturas ambiente y del organismo, creando un entorno propicio para la vida. Por ejemplo, en los océanos, el agua modera las condiciones climáticas costeras, mientras que en los organismos, ayuda en la dispersión del calor durante procesos metabólicos.
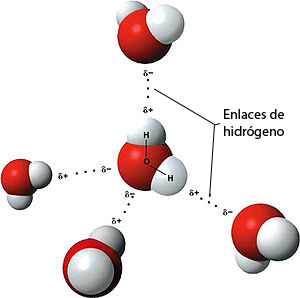
Enlaces por puentes de hidrógeno.
Entre las moléculas de agua se establece un tipo de enlace intermolecular débil: el enlace por puentes de hidrógeno. Un enlace por puentes de hidrógeno se establece necesariamente entre un átomo con un diferencial de carga negativo y otro con diferencial de carga positivo. Estos átomos pueden estar en diferentes moléculas como en el caso que nos ocupa, o ser parte de una misma gran molécula, como a menudo sucede en las proteínas.
En el caso del agua podemos decir que una molécula de agua puede unirse con hasta otras cuatro moléculas diferentes de agua, si bien estas uniones son de muy corta duración en el tiempo; los enlaces de hidrógeno se forman y destruyen de manera muy rápida: la duración de cada uno de ellos en el agua líquida viene a ser del orden de 10 elevado a la –10 a 10 elevado a la –21 segundos. Pueden por eso formarse grupos de 3, 4 y hasta 9 moléculas de agua. Con ello se alcanzan pesos moleculares relativamente altos que son la causa de que el agua sea líquida a temperatura ambiente y tenga todas las propiedades típicas de un fluido.
El agua en los sistemas biológicos
En los sistemas biológicos, el agua no solo es un medio para el transporte de moléculas, sino que también participa en reacciones importantes como la fotosíntesis y la respiración celular. Mediante la ósmosis, regula el balance hídrico en las células, manteniendo la presión osmótica adecuada. Además, el agua participa en el mantenimiento de la estructura tridimensional de las proteínas y ácidos nucleicos, estabilizando interacciones moleculares necesarias para su función.
Propiedades químicas del agua.
- Elevada fuerza de cohesión entre sus moléculas: debido a los puentes de hidrógeno que se establecen las moléculas de agua permanecen unidas entre sí de forma más intensa que en otros compuestos similares.
- El agua es un líquido prácticamente incompresible: no es fácil reducir su volumen mediante presión, pues las moléculas de agua están enlazadas entre sí manteniendo unas distancias intermoleculares más o menos fijas. Por ello muchos organismos usan agua para fabricar sus esqueletos hidrostáticos, como los anélidos y celentéreos.
- Elevada tensión superficial: su superficie opone gran resistencia a romperse, lo que permite que muchos organismos puedan “andar” sobre el agua y vivan asociados a esa película superficial.
- Capilaridad: ascenso de la columna de agua a través de tubos de diámetro capilar, fenómeno que depende de la capacidad de adhesión de las moléculas de agua a las paredes de los conductos capilares y de la cohesión de las moléculas de agua entre si. Las plantas utilizan esta propiedad para la ascensión de la sabia bruta por el xilema.
- Elevado calor específico: Hace falta mucha energía para elevar su temperatura. esto convierte al agua en un buen aislante térmico.
- Elevado calor de vaporización: debido a que para pasar al estado sólido parte de la energía suministrada se emplea en romper los enlaces de puentes de hidrógeno.
- Mayor densidad en estado liquido que en estado sólido: el hielo flota en el agua.
Esta particularidad se debe a la formación de una estructura de retículo cristalino en el hielo, menos densa que el agua líquida, lo cual provoca que el hielo flote. Este fenómeno es fundamental para las masas de agua en climas fríos, ya que el hielo flotante aísla el agua subyacente, permitiendo la supervivencia de organismos al mantener temperaturas menos extremas en las capas inferiores.
- Elevada constante dieléctrica. Al ser un dipolo el agua se convierte en el gran disolvente universal: compuestos iónicos y polares se disuelven fácilmente en agua.
El agua actúa como un excelente disolvente debido a su naturaleza polar, lo que le permite disolver una gran variedad de sustancias químicas, como sales, azúcares, ácidos y gases. Gracias a su elevada constante dieléctrica, reduce la fuerza de atracción entre iones opuestos en compuestos iónicos, facilitando su disolución. Por ello, muchas reacciones bioquímicas en los organismos dependen de la capacidad del agua para actuar como medio disolvente efectivo, permitiendo que las moléculas interactúen libremente.
- Bajo grado de ionización: sólo una de cada 551.000.000 moléculas de agua se encuentra disociada en forma iónica. La concentración de iones hidroxilo (OH-1) y de iones de hidrógeno (protones) H+ es la misma 10-7 molar. El agua es desde el punto de vista del pH, neutra.
