Tinción GRAM
La tinción GRAM es uno de los procesos más utilizados a la hora de determinar al microscopio óptico la filogenia de un microorganismo. Siendo una de las primeras pruebas que se hacen para clasificar a un posible patógeno. Fue desarrollada en 1884 por el bacteriólogo danés Christian Gram. El proceso tradicional fue mejorado por Hucker en 1921, hallando la manera de que los reactivos fueran más estables y mejorando la calidad diferenciadora del proceso. Existe otra modificación diseñada por Kopeloff en 1923 que permitía teñir de forma más eficiente aquellas bacterias de difícil tinción, sobre todo las anaerobias. No obstante la explicación de porqué se teñían de forma diferente tuvo que esperar hasta 1974 cuando Gregersen estableció que las diferencias entre las GRAM+ y las GRAM- eran debidas a la diferente composición de la pared celular.
Aunque las Archaea también responden a la tinción GRAM, son las especies del Reino Bacteria las que se dividen tradicionalmente entre las GRAM+ (GRAM positivas) que son aquellas bacterias que se tiñen con este procedimiento y las GRAM- (GRAM negativas) que no retienen el tinte.
Pasos para teñir bacterias con la tinción de GRAM:
Fijación: Primero de todo hay que coger bacterias sanas de un cultivo y ponerlas en un portaobjetos (el el laboratorio muchas veces se abrevia por “porta”) y secar la gota bien con mechero, sin quemar ni hervir las células, o bien al aire.
Tinción 1: durante 1 minuto se cubre la superficie donde están las bacterias con unas pocas gotas del colorante cristal violeta. Pasado este tiempo se elimina el exceso y se lava el portaobjetos con agua corriente, con cuidado para que el chorro de agua no caiga directamente sobre la muestra ni sea un flujo demasiado rápido como para eliminar las bacterias del porta.
Tinción 2: Aquí es donde se introdujeron las mejoras de Hucker, agregando lugol durante 30 segundos y decolorando con alcohol: acetona (en proporciones 1:1) 3 segundos y se vuelve a lavar como antes. La modificación de Kopeloff utiliza como decolorante alcohol-acetona (7:3) segundos y los tiempos de tinción son diferentes.
Tinción 3: Se añade safranina durante 30 segundos y se vuelve a lavar. Que puede sustituirse por carbol-fucsina, para bacterias anaerobias.
Se deja secar y ya puede verse al microscopio óptico las bacterias teñidas
Teoría de la tinción:
Las células bacterianas sanas y vivas se tiñen sin problemas con cristal violeta, un colorante básico y se tiñen poco o nada con colorantes ácidos, como la eosina. El cristal violeta es introducido activamente por las bacterias, por eso solo las vivas se teñirán, además las características ácidas de las células procariotas son las que permiten esta coloración básica.
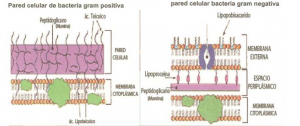
Detalle de la pared de las bacterias GRAM+ y GRAM- donde se puede apreciar la diferencia entre los péptidoglucanos.
El lugol forma un compuesto insoluble con el cristal violeta. El lavado con alcohol: acetona, un solvente lipídico, actúa en la pared celular y afecta a la membrana plasmática a la que se unen los péptidoglucanos de la pared en las bacterias GRAM- de tal manera que dejan salir el complejo lugol-cristal violeta.
Por otra parte las GRAM+ poseen una gruesa pared de péptidoglucanos con pocos lípidos por lo que el alcohol: acetona no puede entrar y retienen el colorante. Si la decoloración no se lleva a cabo correctamente las bacterias GRAM- pueden aparecer como positivas.
Para concluir se añade la safranina que es un tinte de contraste que tiñe en rojo, de esta manera las células GRAM- quedan teñidas en rojo-rosa de forma diferenciadora de las GRAM+ que se tiñen en violeta intenso o azul.
