Estructura de las proteínas
La actividad biológica de una proteína depende en gran medida de la disposición espacial de su cadena polipeptídica. Efectivamente, la cadena polipeptídica sufre una serie de plegamientos que la capacitan para llevar a cabo su función biológica. Estos plegamientos proporcionan una complejidad extraordinaria a la estructura de las proteínas, para la que se han descrito cuatro niveles diferentes, conocidos como estructura primaria, secundaria, terciaria y cuaternaria, cada uno de los cuales se construye a partir del nivel anterior.
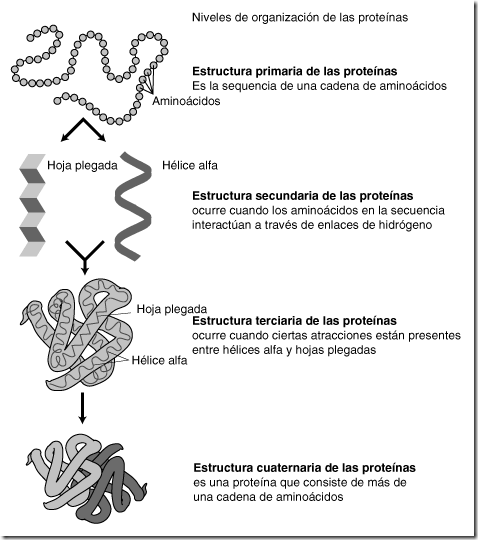
Estructura primaria de las proteínas.
Se denomina de esta forma la secuencia de los aminoácidos en la cadena polipeptídica. El número, el tipo y el orden o la secuencia de los aminoácidos que constituyen la estructura primaria son distintos en cada proteína. Siempre existe un extremo con un aminoácido-cuyo grupo amino está libre y otro extremo con un aminoácido con su grupo carboxilo libre. Por convenio, los aminoácidos de la cadena se numeran comenzando por el que posee el extremo amino libre.
Estructura secundaria.
Aunque la disposición de la cadena polipeptídica en el espacio puede adoptar múltiples formas, existe una conformación más estable que ninguna otra que, lógicamente, es la que se mantiene. Este plegamiento estable se denomina estructura secundaria, de la que existen dos tipos básicos. En las proteínas coexisten ambos, aunque uno de ellos puede predominar sobre el otro. Se ha comprobado que ciertas combinaciones de las dos estructuras (conocidas como dominios estructurales) son tan estables que se encuentran presentes en muchas proteínas, incluso con funciones distintas.
Los dos tipos básicos de estructuras secundarias son la alfa hélice y la lámina plegada o lámina beta.
Estructura en alfa hélice
Consiste en un plegamiento en espiral de la cadena polipeptídica sobre sí misma. Este enrollamiento sigue el sentido de giro de las agujas del reloj y contiene 3,6 aminoácidos por cada vuelta.
La expresión «3,6 aminoácidos» indica que en una vuelta completa de la hélice hay tres aminoácidos y parte de otro, cuya segunda porción pertenece a la siguiente vuelta.
El plegamiento se mantiene estable por medio de puentes de hidrógeno entre el grupo amino (que forma parte de un enlace peptídico) de un aminoácido y el grupo carboxilo (que forma parte de otro enlace peptídico) del cuarto aminoácido que le sigue en la cadena lineal.
Si estos enlaces se rompen, la estructura secundaria se pierde.
Las cadenas laterales de los aminoácidos no intervienen en los enlaces y aparecen proyectadas hacia la parte externa de la alfa-hélice.
Lámina plegada
También se conoce como estructura beta, porque la beta queratina, presente en uñas, pelos y plumas, constituye un ejemplo característico. El plegamiento, en este caso, no origina una estructura helicoidal, sino una especie de fuelle o lámina plegada en zigzag, originada por el acoplamiento de segmentos de la misma cadena polipeptídica o de distintas cadenas, unidos entre sí por puentes de hidrógeno transversales análogos a los que estabilizan la alfa-hélice.
Además de la a-hélice y de la lámina plegada existen otros tipos de estructura secundaria, como la triple hélice del colágeno. En ella se asocian tres cadenas trenzadas que originan una triple hélice.
Estructura terciaria.
Resulta del plegamiento sobre sí misma de la estructura secundaria. De la estructura terciaria depende la función de la proteína, por lo que cualquier cambio en la disposición de esta estructura puede provocar la pérdida de su actividad biológica.
La estructura terciaria es, por tanto, un conjunto de plegamientos característicos que se originan por la unión entre determinadas zonas de la cadena polipeptídica. Estas uniones se realizan por medio de enlaces entre las cadenas laterales R de los aminoácidos.
Los enlaces pueden ser de cuatro tipos:
-
Puentes disulfuro. Constituyen fuertes enlaces covalentes entre dos grupos — SH que pertenecen a sendos aminoácidos “cisteina”.
-
Fuerzas electrostáticas. Se trata de enlaces de tipo iónico entre grupos con cargas eléctricas opuestas.
-
Puentes de hidrógeno. Se establecen entre grupos polares no iónicos en los que existen cargas parciales en su cadena lateral.
-
Fuerzas de Van der Waals e interacciones hidrofóbicas. Son las uniones más débiles y se producen entre aminoácidos apolares.
De lo anterior se deduce que la sustitución de un aminoácido por otro en la cadena polipeptídica puede alterar la estructura tridimensional de la proteína, al no formarse alguno de los enlaces citados, y modificar, en consecuencia, los plegamientos, tanto en el nivel secundario como en el terciario. Resulta evidente, pues, la enorme importancia que tiene la estructura primaria en la adquisición de la correcta estructura espacial de la proteína.
Estructura cuaternaria.
En ocasiones existe otro nivel estructural por encima del anterior. Esto ocurre únicamente cuando la proteína está constituida por más de una cadena polipeptídica, denominadas en este caso subunidades proteicas.
La estructura cuaternaria es, sencillamente, la disposición relativa que adoptan las subunidades proteicas entre sí. La unión entre ellas se realiza mediante los mismos tipos de enlaces que mantienen la estructura terciaria, establecidos esta vez entre las cadenas laterales de los aminoácidos de las distintas subunidades.
