Transporte a través de la envoltura nuclear: exportación
En las células eucariotas el transporte de las proteínas al interior del núcleo es de vital importancia para la modulación de la expresión génica o la división celular, entre otras funciones. De igual manera la exportación de las proteínas después de cumplir su función es importante para que una vez realizada su tarea esas proteínas sean degradadas. El núcleo está rodeado por una doble membrana lipídica, que en conjunto se denomina envoltura nuclear, puedes leer algunos datos sobre ella en nuestro artículo aquí .
Las proteínas con un tamaño mayor de 50 KDa deben asociarse a proteínas especiales para su entrada y salida del núcleo. Para entrar al núcleo las proteínas deben asociarse con importinas, de las que puedes leer más en el artículo que les dedicamos aquí (próximamente). Para su transferencia fuera del núcleo las proteínas deben asociarse a exportinas.
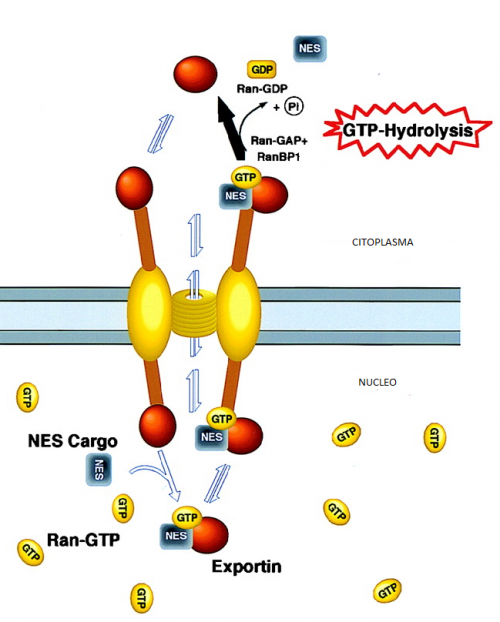
Esquema de la exportación. (Modificado de PNAS, 1996)
Una molécula que está dentro del núcleo y debe ser transferida al citoplasma debe tener una secuencia que las exportinas sean capaces de reconocer. Esta secuencia de aminoácidos, formará el dominio que se denomina NES (del inglés nuclear exportation signal). Esta secuencia NES también se encuentra en las exportinas, y es el lugar de interacción entre ambas proteínas. El mecanismo de exportación es similar al de importación con sus dominios NLS. La secuencia de aminoácidos consenso está formada por 4 aa hidrofóbicos, siendo él aminoácido más común la leucina entre los que se intercalan otros aminoácidos indiferentes, que permitirán la formación de una estructura concreta para la interacción con la exportina. El dominio NES se conforma de la siguiente manera: LXXXLXXLXL (siendo L los aminoácidos hidrofóbicos y X los otros aminoácidos).
El mecanismo de exportación comienza con la unión entre la exportina y Ran-GTP, una GTPasa involucrada tanto en la exportación como la importación. La unión de Ran induce cambios conformacionales en la exportina. De esta manera la afinidad de la exportina por los dominios NES aumenta y se forma un trímero de Ran-exportina-cargo.
Este heterotrímero sale por el poro nuclear. En el citoplasma celular el GTP que acarreaba Ran es hidrolizado a GDP por proteínas GAPs (GTPasas activating protein) y se separa de las otras dos proteínas. Como consecuencia de ello la afinidad de la exportina por los dominios NES disminuye y también se separa de la proteína cargo. Para regresar al núcleo Ran-GDP se mueve a través de la membrana nuclear a favor de gradiente de concentración. En el interior del núcleo la concentración de Ran-GDP es muy baja dado que dentro se encuentra la proteína RanGEF que fosforila Ran-GDP a Ran-GTP. Hay que remarcar que la regeneración de Ran es el paso que cuesta energía del transporte a través de la envoltura nuclear. La exportina por su parte al ser menores de 50 KDa puede entrar al núcleo sin necesidad de ser transportadas activamente.
Todos los ARN, ribosómicos o de transferencia usan el sistema de las exportinas para viajar al citoplasma. Sin embargo los ARNs están formados de bases nitrogenadas y no de aminoácidos y necesitan unirse a proteínas que funcionan de puente entre el ARN y las exportinas para poder sacarlos del núcleo. Para evitar su exportación antes de tiempo muchas proteínas fosforilan el dominio NES para esconderlo de las exportinas.

