La familia de la Actina
La actina es una familia de proteínas globulares fundamental en el movimiento de eucariotas, tanto celular como muscular. Las actinas son unas proteínas evolutivamente muy conservadas, siendo casi idéntica en organismos muy separados evolutivamente. FtsZ y MreB son los genes de movilidad en bacterias y arqueas que mantienen una similitud con la actina del 50%.
La actina forma los llamados filamentos de actina (o microfilamentos) del citoesqueleto que le otorgan a los seres unicelulares y a células de los organismos pluricelulares movilidad dentro de su entorno y además colaboran en el mantenimiento de la estructura tridimensional del citoesqueleto de las células y en la división celular, apoptosis, adhesión celular y modula la expresión de genes relacionados con el desarrollo de la célula. (Para saber más sobre el citoesqueleto puedes leer el artículo que le dedicamos aquí).
La actina está codificada en humanos en 6 genes cada uno con seis exones normalmente, capaces de dar 21 isoformas por splicing alternativo. De media tienen 374 aminoácidos, de los cuales su extremo N-terminal son ácidos y su extremo C-terminal es básico. Existen varios pseudogenes tanto en animales como en plantas, que hacen que la familia llegue hasta más de 60 copias en plantas y más de 30 en animales. La isoforma más abundante es la actina alpha relacionada con movimiento muscular el resto se denominan beta, gamma y kappa.
Los seis genes de mamíferos presentan diferentes funciones: Dos de ellos ACTB (actina beta) y ACTG1 (actina gamma 1) son los encargados del citoesqueleto. ACTA1 codifica para la isoforma alpha, que actúa en el músculo esquelético, aunque también está presente en el músculo cardiaco y en el tiroides. ACTA2 es una isoforma alpha que actúa en el músculo liso. ACTG2 es una isoforma gamma que se encarga del movimiento del músculo liso entérico y ACTC1 (actina alpha) en el músculo cardiaco.
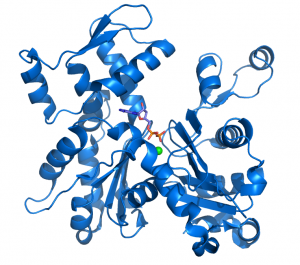
Un esquema de una molécula de Actina unida a ADP
La actina puede presentar dos conformaciones, actina G, son los monómeros de actina que no están formando los filamentos y por lo tanto están disueltas en el citoplasma. Su estructura plegada forma dos dominios separados por una hendidura en la que se encuentra la actividad ATPasa necesaria para formar los filamentos. La otra conformación, actina F, es la que se encuentra formando los filamentos de actina.
Los filamentos de actina tienen un diámetro de 7 nm, forman una espiral de unos 2,17 monómeros de actina por vuelta. Son los filamentos más finos de todos los que forman el citoesqueleto. Dichos filamentos tienen polaridad, es decir hay un extremos, al que llamamos extremo + (positivo) por el que crecer (se polimeriza la actina) y un extremo – (negativo) por el que se despolimeriza. Los filamentos de actina están constantemente polimerizando y despolimerizando, manteniendo un equilibrio estable, lo que lo convierte en la parte más dinámica del citoesqueleto. Pero no hay que pensar que los filamentos se forman o destruyen espontáneamente, para formarse necesitan una señal, Arp2 o Arp3 o también las llamadas forminas, que se localizan en los sitios donde son necesarios los filamentos y para destruirse se unen a proteínas como la cofilina o la gelsolina. Los filamentos de actina no son pilares desnudos, sino que interaccionan con más proteínas, algunas de ellas capaces de establecer “puentes” entre filamentos formando haces de filamentos, como las fimbrinas; otras proteínas de anclaje a la membrana; y proteínas como las tropomiosina que media su interacción con la meiosina del movimiento muscular.
En los estudios de cantidad de proteína se suele emplear la actina como control positivo puesto que todas las células presentan una alta concentración de ella. Estos datos dan una idea de la importancia de la actina para la célula.

