Propiedades de las proteínas
Solubilidad
Normalmente, las proteínas con estructura terciaria fibrilar (alargada) son insolubles en agua, mientras que las que poseen estructura globular (redondeadas) son solubles. Debido a su elevada masa molecular, cuando las proteínas son solubles forman disoluciones coloidales. En ellas, muchos de los aminoácidos apolares se sitúan en el interior de la estructura, y los polares, que pueden unirse por puentes de hidrógeno a las moléculas de agua, se localizan en la periferia en contacto con éstas. Existe, pues, una capa de agua alrededor de cada molécula proteica que impide la unión entre ellas (solvatación o hidratación). Si esta capa se pierde, las moléculas de proteína se unen entre sí y forman un agregado insoluble, lo que provoca su precipitación. Esto ocurre cuando aparecen iones (generalmente sales en disolución) que compiten con las cargas de los aminoácidos para unirse a las moléculas de agua de la capa de solvatación.
Alteración de la estructura espacial
La función biológica de las proteínas depende de su estructura tridimensional, también denominada conformación nativa cuando está intacta. Cualquier cambio que suponga una alteración de esta conformación, como sucede, por ejemplo, cuando se rompen los enlaces de la estructura cuaternaria, terciaria y secundaria, afecta a la funcionalidad biológica de la proteína. Este proceso recibe el nombre de desnaturalización y puede ser reversible (si los factores responsables han actuado con escasa intensidad y durante poco tiempo) o irreversible. En el primer caso es posible recuperar la conformación nativa cuando cesa la acción de los factores que han producido su desnaturalización, proceso conocido como renaturalización.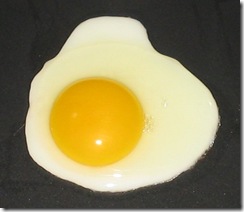
Habitualmente, sin embargo, la desnaturalización suele ser irreversible.
Entre los factores que pueden provocar la desnaturalización proteica se encuentran las variaciones de presión y el aumento de temperatura (agentes físicos) y las variaciones de pH, así como los cambios en la concentración salina (agentes químicos). El efecto del calor sobre la clara de huevo es evidente cuando lo cocemos o freímos.
La adición de cantidades crecientes de sales a una mezcla de proteínas en disolución permite la separación de éstas. Las proteínas que tienen pocas cargas en su periferia para mantener la capa de solvatación precipitan enseguida, ya que esta capa es eliminada por las sales ionizadas. Sin embargo, las proteínas muy solubles necesitan una cantidad de sales mayor para perder su capa de solvatación. Se produce, por tanto, una precipitación fraccionada que, tras una filtración, permite la separación de mezclas de proteínas solubles.
Especificidad
Las proteínas son moléculas específicas, es decir, cada especie biológica posee algunas proteínas que otros organismos no tienen. Incluso proteínas que presentan la misma función y una estructura tridimensional muy semejante suelen tener una secuencia peptídica algo diferente en distintos organismos. Este hecho posee una gran importancia, ya que el análisis de las semejanzas que existen entre algunas proteínas de diversos grupos de seres vivos permite llevar a cabo estudios filogenéticos y establecer el parentesco evolutivo entre especies.
La especificidad proteica se observa incluso en individuos de una misma especie.

